Oro de tontos...
En este ejercicio clínico se presenta un caso que es discutido por un médico internista al que se le van proporcionando datos de la historia clínica en forma secuencial, y este analiza el cuadro a la luz de los nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica real de la medicina.
Un hombre de 20 años se presentó al departamento de emergencia después de un episodio sincopal.
Durante las dos semanas previas, el había tenido febrícula, anorexia, rinorrea, y cefalea. La mañana del ingreso, se sintió débil, y después presentó un episodio de pérdida de conocimiento en el baño; no tenía antecedentes de importancia. Su madre, quien presenció la caída, no observó ningún tipo de actividad convulsiva. Cuando recuperó la conciencia dijo haber tenido disnea. Su madre le controló la tensión arterial que fue en ese momento de 86/54 mmHg con un tensiómetro automatico, por lo que decidió traerlo al hospital. En el departamento de emergencias, el paciente permaneció hipotenso y disneico. El electrocardiograma mostró bloqueo completo de rama derecha con desviación del eje a la derecha, hallazgo que no estaba presente 8 m eses antes (Figura 1)
eses antes (Figura 1)
Dos años antes, al paciente se le había realizado un diagnóstico de linfoma linfoblástico de células pre-T estadio IV, cuando tenía 18 años. Además de ciclofosfamida, vincristina, doxorrubicina, y dexametasona, había recibido radioterapia en tórax y metotrexato intratecal. A pesar de una remisión completa después de la inducción y quimioterapia de consolidación, él presentó una recurrencia dentro del año. Se realizó posteriormente transformación leucémica, evidenciada por infiltración linfoblástica de su médula ósea e invasión leptomeningea. Subsecuentemente se sometió a transplante de stem-cell alogénico proporcionada por un hermano, junto con la implantación de un reservorio de Ommaya, e irradiación cerebral total. Estos tratamientos se vieron complicados por convulsiones, y enfermedad de injerto vs huésped, requiriendo terapia a largo plazo con corticosteroides 30 mg por día de prednisona por vía oral y 500 mg de micofenolato mofetil dos veces por día. Una segunda remisión completa fue lograda 3 meses antes de la presentación actual. Él no tenía antecedentes de otra enfermedad significativa excepto por asma de la infancia.
El uso prolongado de corticoides aumenta el riesgo de sepsis y agrega además la posibilidad de insuficiencia adrenal como factor contribuyente a la presenatación del cuadro. El efecto adverso de la doxorrubicina en el corazón, y la radiación torácica en pericardio, miocardio, pulmones, y circulación pulmonar y coronaria deben ser considerados, aunque el compromiso casi exclusivo del corazón derecho, o miocardiopatía derecha sería raro en todas esas situaciones mencionadas, y además, todas ellas ocurren tardiamente después del tratamiento.
La leptomeningitis linfomatosa, la quimioterapia intratecal, y la radiación cerebral total pueden haber causado una disfunción del sistema nervioso autónomo y producir una tendencia o predisposición especial al síncope en un contexto de insulto adicional como por ejemplo, un estado de deshidratación. La embolia pulmonar, todavía continúa siendo una preocupación
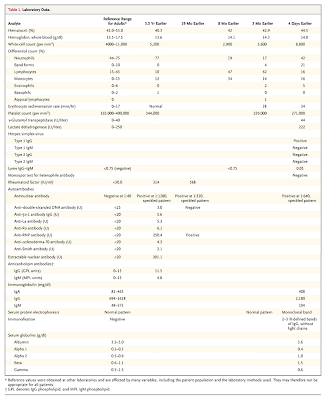
Cuando se lo trasladaba a la unidad de terapia intensiva, el paciente estaba conciente y respondía a los estímulos, pero estaba somnoliento. Estaba afebril, con una presión arterial media de 52 mm Hg, una frecuencia cardíaca de 125 por minuto, y una frecuencia respiratoria de 25 por minuto, con una saturación de oxígeno de 98% mientras se le administraba oxígeno a un ritmo de 2 litros por minuto por cánula nasal. En el examen físico llamaba la atención la ingurgitación yugular, y un galope por tercer ruido en el borde esternal izquierdo, con auscultación de algunos roncus pero sin rales. La piel estaba eritematosa con placas localizadas, compatibles con enfermedad de injerto vs huésped. Los resultados de laboratorio mostraban un recuento de glóbulos blancos de 7200/mm3 con una fórmula leucocitaria normal, un hematocrito de 42,5%, y un recuento de plaquetas de 155000/mm3. La revisión del frotis de sangre periférica no reveló células leucémicas. La creatinina sérica era de 0,7 mg/dl, y los electrolitos y la función heptática estaban normales. El nivel de troponina I era de 4,2 ng/ml (normal menos de 0,1). La medida de los gases en sangre, mientras el paciente respiraba aire ambiente reveló un pH de 7,43 y una pCO2 de 35 mmHg, con una pO2 de 62 mmHg. La Rx de tórax reveló leve cardiomegalia y edema pulmonar con una posible consolidación basal izquierda. La TAC de craneo no reveló masas ni hemorragia. Teniendo en cuenta la taquipnea, el aumento del gradiente alvéolo-arterial de oxígeno, y los cambios electrocardiográficos, se comenzó terapia empírica para embolismo pulmonar con heparina de bajo peso molecular, mientras se continuaba con la evaluación.
Aunque su relativamente baja presión arterial media pueda contribuir a su status mental alterado, existe preocupación por probable recurrencia del cáncer en sistema nervioso central, o una infección tal como neumonía (en base a la Rx de tórax), meningitis, o sepsis generalizada en un contexto de uso crónico de esteroides. La TAC de cerebro normal es útil pero no descarta recurrencia leptomeningea de linfoma. El examen físico y los estudios iniciales son consistentes con fallo cardíaco biventricular, pero, teniendo en cuenta los elementos electrocadiográficos, el fallo derecho parece ser el dominante. El nivel elevado de troponina puede indicar infarto de miocardio como causa del fallo cardíaco , pero la edad y la ausencia de evidencias electrocardiográficas de infarto, este dato probablemente refleje una sobrecarga de presión y sobrecarga de volumen en los ventrículos, particularmente en el derecho.
Aunque en este punto son importantes las imágenes para descartar embolismo pulmonar, llaman la atención los pródromos que el paciente presentó semanas antes de un síndrome de repercusión general, lo cual no es común en el tromboembolismo pulmonar, y dado su condición de inmunodeprimido, deben enfatizarse las medidas tendientes a descartar infección pulmonar o en algún otro sitio.
La posibilidad de recurrencia de su cáncer debe ser también considerada, sobre todo si se descartan el tromboembolismo pulmonar y la infección. Los hallazgos de la Rx de tórax pueden reflejar linfangitis carcinomatosa o enfermedad metastásica afectando el parénquima pulmonar o un proceso que ocluye selectivamente la vasculatura pulmonar (linfomatosis intravascular o embolia tumoral).
El análisis del líquido cefalorraquídeo reveló una presión normal, con un recuento celular de menos de 1 célula blanca /mm3, menos de 1 célula roja/mm3, un total de 14 mg de proteínas (valor normal menos de 45 mg/dl), y un nivel de glucosa de 58 mg/dl (normal 50 a 80 mg/dl). La coloración de Gram en busca de microorganismos fue negativa, y la investigación citológica para células neoplásicas fue negativa.
Se le prescribieron “dosis de stress” de corticosteroides, solución salina, y una terapia con antibióticos de amplio espectro con piperacilina-tazobactam y vancomicina.
El eco-Doppler de miembros inferiores fue negativo para trombosis venosa profunda, y una angio-TAC de tórax no demostró embolismo pulmonar. La evaluación del parénquima pulmonar mostró opacidades dispersas en vidrio esmerilado en lóbulos inferiores y medios y en menor grado los segmentos del lóbulo superior derecho. No había zonas de franca consolidación. Un ecocardiograma transtorácico, que había sido normal 8 meses antes, mostró función sistólica preservada, pero una hipertrofia ventricular izquierda nueva importante (Figura 2). El tamaño del ventrículo derecho y su función impresionaban normales.
A la mañana siguiente, la presión arterial y el status mental se habían normalizado, y sus niveles de troponina estaban descendiendo. El nivel del péptido natriurético tipo-B (BNP) era de 2758 pg/ml (rango normal de menos de 300), y el nivel sérico de ferritina era de 2981 pg/ml (normal entre 8 a 282). Los cultivos de sangre, orina, y líquido cefalorraquídeo fueron negativos. En los cultivos de esputo desarrolló solo flora normal siendo negativo para hongos y Pneumocystis jiroveci. La RMN cardíaca con gadolinio reveló moderada hipertrofia ventricular izquierda concéntrica, y tamaño ventricular izquierdo y derecho, así como función sistólica normales. No había evidencias de depósito de hierro, pero se observaba un realce transmural extenso y “parcheado” que no respetaba ningún territorio ventricular (Figura 3). La cateterización del corazón derecho reveló presiones de llenado normal-altas, con un índice cardíaco de 2,1 litros por minuto/metro cuadrado de superficie corporal (normal más de 2,5).
corporal (normal más de 2,5).
Se llevó a cabo una biopsia endomiocárdica del ventrículo derecho, no revelando evidencias de ninguna enfermedad infiltrativa, injuria inducida por radiación, enfermedad de injerto vs huésped, leucemia, o miocarditis en la tinción con hematoxilina-eosina, microscopía electrónica, y examen por inmunofluorescencia (Figura 4).
Una PCR para citomegalovirus fue negativa, así como el cultivo viral. Dado su status hemodinámico mejorado, y el resultado normal de todos los tests, los clínicos sospecharon que el evento sincopal había ocurrido como resultado de deshidratación por enfermedad viral sobreagregada, sobre una miocardiopatía restrictiva no diagnosticada previamente. Dado que repetir otra biopsia endomiocárdica fue considerada de bajo rédito diagnóstico y a la negativa por parte del paciente de someterse a nuevos tests invasivos, se le dió el alta con un plan de seguimiento ambulatorio. En dos visitas posteriores, el paciente reportó tener disnea de esfuerzo, y continuó teniendo un galope por tercer ruido. Un nuevo ecocardiograma reveló hipertrofia ventricular izquierda sin cambios, y una función sistólica igual a la determinada un mes previo. El nivel de troponina I varias semanas despés del alta permanecía elevada en niveles de 0,9 ng/ml.
La ausencia de progresión ecocardiográfica en 1 mes es una buena noticia, pero su disnea es preocupante. La elevación modesta pero persistente de la troponina ha sido descripta en pacientes con enfermdades infiltrativas, tales como la amiloidosis. Existe la posibilidad de un resultado falso negativo de la biopsia, quizá debido a error de de la toma de la muestra.
Aunque la infiltración miocárdica maligna es rara, esta posibilidad permanece siendo particularmente preocupante. Aunque una biopsia de pulmón puede ser necesaria, una nueva biopsia endomiocárdica pude ser de mayor rédito diagnóstico.
Dos meses después de la hospitalización inicial, el paciente presentó disnea aguda e hipotensión. El ecocardiograma rebeló un derrame pericárdico circunferencial complicado por taponamiento cardíaco. El paciente fue llevado a la sala de cirugía para drenaje pericárdico y biopsia miocárdica.
Cuál es el diagnóstico?
Comentario:
Un test falso negativo puede proyectar una larga duda diagnóstica. En este caso, una biopsia endomiocárdica negativa oscureció el diagnóstico final y dificultó el manejo.
Después de la presentación imicial con hipotensión, síncope, y evidencias electrocardiográficas de sobrecarga del corazón derecho, los médicos tratantes consideraron embolia pulmonar.
El uso de corticosteroides por períodos prolongados también hicieron que la sepsis e insuficiencia suprarrenal fueran consideradas. En el proceso de evaluación, se encontró una miocardiopatía. Comparando con un ecocardiograma previo, se observó una rápida progresión de engrosamiento de la pared ventricular; rápidamente se interpretó como un proceso infiltrativo y no como una hipertrofia.
Aunque muy sensible para un proceso miocárdico difuso, tal como amiloidosis, la biopsia endomiocárdica es insensible para enfermedades de distribución “parcheada” o parcelar (por ej sarcoidosis). Una biopsia ventricular izquierda puede ser llevada a cabo si la RMN sugiere lesión exclusiva en ventrículo izquierdo, (5) pero este procedimiento está asociado a mayor riesgo y morbilidad. Cuando un resultado negativo es incompatible con el cuadro clínico, se debe repetir la biopsia para aumentar el rédito diagnóstico.
El linfoma, la leucemia, y sus tratamientos pueden tener profundos efectos en el miocardio y en el pericardio. (6) La radiación torácica puede inducir fibrosis del miocito, cicatrices pericárdicas, estenosis valvulares, y enfermedad aterosclerótica prematura, pero esas complicaciones no son clínicamente evidentes hasta años o décadas después del tratamiento. La quimioterapia con antraciclícos puede causar apoptosis dosis-dependiente y cardiomiopatía dilatada.
La infiltración leucémica es muy rara, pero estáperfectamente descripta en la enfermedad avanzada. (7) Aunque es improbable que un diagnóstico precoz de esta segunda recurrencia del cáncer hubiera alterado la evolución de la enfermedad, el reconocimiento del proceso antes de lo que se hizo en este caso, podría haber cambiado la evolución clínica.
Este caso subraya la importancia de la aplicación de los principios Bayesianos en todas las fases de la evaluación diagnóstica. Las consideraciones del contexto clínico son críticas cuando se interpretan los resultados de los tests diagnósticos, aún cuando esos tests se consideren los “gold standards” (patrón oro)
Traducción de :
Fool's Gold
Nicholas J. Leeper, M.D., Gurpreet Dhaliwal, M.D., Sanjay Saint, M.D., M.P.H., and Ronald M. Witteles, M.D.
Clinical Proble-Solving
Volume 359:2035-2041 November 6, 2008 Number 19
Un hombre de 20 años se presentó al departamento de emergencia después de un episodio sincopal.
Durante las dos semanas previas, el había tenido febrícula, anorexia, rinorrea, y cefalea. La mañana del ingreso, se sintió débil, y después presentó un episodio de pérdida de conocimiento en el baño; no tenía antecedentes de importancia. Su madre, quien presenció la caída, no observó ningún tipo de actividad convulsiva. Cuando recuperó la conciencia dijo haber tenido disnea. Su madre le controló la tensión arterial que fue en ese momento de 86/54 mmHg con un tensiómetro automatico, por lo que decidió traerlo al hospital. En el departamento de emergencias, el paciente permaneció hipotenso y disneico. El electrocardiograma mostró bloqueo completo de rama derecha con desviación del eje a la derecha, hallazgo que no estaba presente 8 m
 eses antes (Figura 1)
eses antes (Figura 1)
Figura 1. Panel A: ECG obtenido 8 meses antes ded la presentación, y Panel B muestra un bloqueo completo de rama derecha nuevo, que no lo presentaba o meses antes (Panel A)
En ausencia de signos electrocardiográficos, la explicación para la secuencia de eventos podrían ser: deshidratación asociada a infección del tracto respiratorio superior prolongada, que condujo a síncope ortostático. Otras causas comunes de hipotensión asociada a síncope son algunos medicamentos y el componente vasodepresor del síncope neurocardiogénico, aunque la duración prolongada de hipotensión (todavía presente en laevaluación en el departamento de emergencias) sería improbable en las causas puramente neurocardiogénicas.
Los hallazgos electrocardiográficos, sin embargo, sugieren un trastorno cardíaco o pulmonar, que, junto a taquipnea, disnea, y síncope, hacen sospechar el diagnóstico de embolia pulmonar. Los pródromos de un cuadro séptico son una importante consideración en este caso también.
Los hallazgos electrocardiográficos, sin embargo, sugieren un trastorno cardíaco o pulmonar, que, junto a taquipnea, disnea, y síncope, hacen sospechar el diagnóstico de embolia pulmonar. Los pródromos de un cuadro séptico son una importante consideración en este caso también.
Dos años antes, al paciente se le había realizado un diagnóstico de linfoma linfoblástico de células pre-T estadio IV, cuando tenía 18 años. Además de ciclofosfamida, vincristina, doxorrubicina, y dexametasona, había recibido radioterapia en tórax y metotrexato intratecal. A pesar de una remisión completa después de la inducción y quimioterapia de consolidación, él presentó una recurrencia dentro del año. Se realizó posteriormente transformación leucémica, evidenciada por infiltración linfoblástica de su médula ósea e invasión leptomeningea. Subsecuentemente se sometió a transplante de stem-cell alogénico proporcionada por un hermano, junto con la implantación de un reservorio de Ommaya, e irradiación cerebral total. Estos tratamientos se vieron complicados por convulsiones, y enfermedad de injerto vs huésped, requiriendo terapia a largo plazo con corticosteroides 30 mg por día de prednisona por vía oral y 500 mg de micofenolato mofetil dos veces por día. Una segunda remisión completa fue lograda 3 meses antes de la presentación actual. Él no tenía antecedentes de otra enfermedad significativa excepto por asma de la infancia.
El uso prolongado de corticoides aumenta el riesgo de sepsis y agrega además la posibilidad de insuficiencia adrenal como factor contribuyente a la presenatación del cuadro. El efecto adverso de la doxorrubicina en el corazón, y la radiación torácica en pericardio, miocardio, pulmones, y circulación pulmonar y coronaria deben ser considerados, aunque el compromiso casi exclusivo del corazón derecho, o miocardiopatía derecha sería raro en todas esas situaciones mencionadas, y además, todas ellas ocurren tardiamente después del tratamiento.
La leptomeningitis linfomatosa, la quimioterapia intratecal, y la radiación cerebral total pueden haber causado una disfunción del sistema nervioso autónomo y producir una tendencia o predisposición especial al síncope en un contexto de insulto adicional como por ejemplo, un estado de deshidratación. La embolia pulmonar, todavía continúa siendo una preocupación
Cuando se lo trasladaba a la unidad de terapia intensiva, el paciente estaba conciente y respondía a los estímulos, pero estaba somnoliento. Estaba afebril, con una presión arterial media de 52 mm Hg, una frecuencia cardíaca de 125 por minuto, y una frecuencia respiratoria de 25 por minuto, con una saturación de oxígeno de 98% mientras se le administraba oxígeno a un ritmo de 2 litros por minuto por cánula nasal. En el examen físico llamaba la atención la ingurgitación yugular, y un galope por tercer ruido en el borde esternal izquierdo, con auscultación de algunos roncus pero sin rales. La piel estaba eritematosa con placas localizadas, compatibles con enfermedad de injerto vs huésped. Los resultados de laboratorio mostraban un recuento de glóbulos blancos de 7200/mm3 con una fórmula leucocitaria normal, un hematocrito de 42,5%, y un recuento de plaquetas de 155000/mm3. La revisión del frotis de sangre periférica no reveló células leucémicas. La creatinina sérica era de 0,7 mg/dl, y los electrolitos y la función heptática estaban normales. El nivel de troponina I era de 4,2 ng/ml (normal menos de 0,1). La medida de los gases en sangre, mientras el paciente respiraba aire ambiente reveló un pH de 7,43 y una pCO2 de 35 mmHg, con una pO2 de 62 mmHg. La Rx de tórax reveló leve cardiomegalia y edema pulmonar con una posible consolidación basal izquierda. La TAC de craneo no reveló masas ni hemorragia. Teniendo en cuenta la taquipnea, el aumento del gradiente alvéolo-arterial de oxígeno, y los cambios electrocardiográficos, se comenzó terapia empírica para embolismo pulmonar con heparina de bajo peso molecular, mientras se continuaba con la evaluación.
Aunque su relativamente baja presión arterial media pueda contribuir a su status mental alterado, existe preocupación por probable recurrencia del cáncer en sistema nervioso central, o una infección tal como neumonía (en base a la Rx de tórax), meningitis, o sepsis generalizada en un contexto de uso crónico de esteroides. La TAC de cerebro normal es útil pero no descarta recurrencia leptomeningea de linfoma. El examen físico y los estudios iniciales son consistentes con fallo cardíaco biventricular, pero, teniendo en cuenta los elementos electrocadiográficos, el fallo derecho parece ser el dominante. El nivel elevado de troponina puede indicar infarto de miocardio como causa del fallo cardíaco , pero la edad y la ausencia de evidencias electrocardiográficas de infarto, este dato probablemente refleje una sobrecarga de presión y sobrecarga de volumen en los ventrículos, particularmente en el derecho.
Aunque en este punto son importantes las imágenes para descartar embolismo pulmonar, llaman la atención los pródromos que el paciente presentó semanas antes de un síndrome de repercusión general, lo cual no es común en el tromboembolismo pulmonar, y dado su condición de inmunodeprimido, deben enfatizarse las medidas tendientes a descartar infección pulmonar o en algún otro sitio.
La posibilidad de recurrencia de su cáncer debe ser también considerada, sobre todo si se descartan el tromboembolismo pulmonar y la infección. Los hallazgos de la Rx de tórax pueden reflejar linfangitis carcinomatosa o enfermedad metastásica afectando el parénquima pulmonar o un proceso que ocluye selectivamente la vasculatura pulmonar (linfomatosis intravascular o embolia tumoral).
El análisis del líquido cefalorraquídeo reveló una presión normal, con un recuento celular de menos de 1 célula blanca /mm3, menos de 1 célula roja/mm3, un total de 14 mg de proteínas (valor normal menos de 45 mg/dl), y un nivel de glucosa de 58 mg/dl (normal 50 a 80 mg/dl). La coloración de Gram en busca de microorganismos fue negativa, y la investigación citológica para células neoplásicas fue negativa.
Se le prescribieron “dosis de stress” de corticosteroides, solución salina, y una terapia con antibióticos de amplio espectro con piperacilina-tazobactam y vancomicina.
El eco-Doppler de miembros inferiores fue negativo para trombosis venosa profunda, y una angio-TAC de tórax no demostró embolismo pulmonar. La evaluación del parénquima pulmonar mostró opacidades dispersas en vidrio esmerilado en lóbulos inferiores y medios y en menor grado los segmentos del lóbulo superior derecho. No había zonas de franca consolidación. Un ecocardiograma transtorácico, que había sido normal 8 meses antes, mostró función sistólica preservada, pero una hipertrofia ventricular izquierda nueva importante (Figura 2). El tamaño del ventrículo derecho y su función impresionaban normales.

Figura 2. Ecocardiograma obtenido 8 meses antes de la presentación (Panel A) y en la presentación (Panel B)
En un eje largo paraesternal, Panel B, muestra marcada hipertrofia concéntrica (flecha), comparada con un ecocardiograma obtenido 8 meses antes (Panel A, flecha)
El líquido cefalorraquídeo normal disminuye enormemente la probabilidad de una meningitis linfomatosa. Los resultados de la angio-TAC, el eco-doppler de miembros inferiores normal y la TAC de tórax, argumentan en contra de embolismo pulmonar; la heparina debiera ser interrumpida. Las opacidades en vidrio esmerilado de la TAC son inespecíficas, pero, dado el contexto clínico, sugieren neumonía viral severa, neumonía por pneumocystis (de particular riesgo por sus antecedentes de cáncer y de uso de corticoides), edema pulmonar, o cáncer. Debe continuarse con antibióticos de amplio espectro y debe considerarse la posibilidad de practicar broncoscopía con BAL para obtención de muestras microbiológicas y citológicas.
La ausencia de disfunción ventricular derecha y el inusualmente rápido desarrollo de hipertrofia ventricular izquierda en el ecocardiograma son preocupantes e inesperados. En ausencia de antecedentes de severa HTA o estenosis aórtica, la hipertrofia ventricular izquierda sugiere un trastorno infiltrativo. La sarcoidosis, y la amiloidosis (especialmente la amiloidosis transtiretina considerando su edad), son posibilidades diagnósticas, pero la progresión de sarcoidosis sería improbable en un paciente que toma corticoides por largos períodos. Con sus antecedentes, existe la posibilidad de linfoma que invade el miocardio, así como el intersticio pulmonar o la vasculatura. La elevación del nivel de troponina podría ser por infiltración linfomatosa de los ventrículos.
En un eje largo paraesternal, Panel B, muestra marcada hipertrofia concéntrica (flecha), comparada con un ecocardiograma obtenido 8 meses antes (Panel A, flecha)
El líquido cefalorraquídeo normal disminuye enormemente la probabilidad de una meningitis linfomatosa. Los resultados de la angio-TAC, el eco-doppler de miembros inferiores normal y la TAC de tórax, argumentan en contra de embolismo pulmonar; la heparina debiera ser interrumpida. Las opacidades en vidrio esmerilado de la TAC son inespecíficas, pero, dado el contexto clínico, sugieren neumonía viral severa, neumonía por pneumocystis (de particular riesgo por sus antecedentes de cáncer y de uso de corticoides), edema pulmonar, o cáncer. Debe continuarse con antibióticos de amplio espectro y debe considerarse la posibilidad de practicar broncoscopía con BAL para obtención de muestras microbiológicas y citológicas.
La ausencia de disfunción ventricular derecha y el inusualmente rápido desarrollo de hipertrofia ventricular izquierda en el ecocardiograma son preocupantes e inesperados. En ausencia de antecedentes de severa HTA o estenosis aórtica, la hipertrofia ventricular izquierda sugiere un trastorno infiltrativo. La sarcoidosis, y la amiloidosis (especialmente la amiloidosis transtiretina considerando su edad), son posibilidades diagnósticas, pero la progresión de sarcoidosis sería improbable en un paciente que toma corticoides por largos períodos. Con sus antecedentes, existe la posibilidad de linfoma que invade el miocardio, así como el intersticio pulmonar o la vasculatura. La elevación del nivel de troponina podría ser por infiltración linfomatosa de los ventrículos.
A la mañana siguiente, la presión arterial y el status mental se habían normalizado, y sus niveles de troponina estaban descendiendo. El nivel del péptido natriurético tipo-B (BNP) era de 2758 pg/ml (rango normal de menos de 300), y el nivel sérico de ferritina era de 2981 pg/ml (normal entre 8 a 282). Los cultivos de sangre, orina, y líquido cefalorraquídeo fueron negativos. En los cultivos de esputo desarrolló solo flora normal siendo negativo para hongos y Pneumocystis jiroveci. La RMN cardíaca con gadolinio reveló moderada hipertrofia ventricular izquierda concéntrica, y tamaño ventricular izquierdo y derecho, así como función sistólica normales. No había evidencias de depósito de hierro, pero se observaba un realce transmural extenso y “parcheado” que no respetaba ningún territorio ventricular (Figura 3). La cateterización del corazón derecho reveló presiones de llenado normal-altas, con un índice cardíaco de 2,1 litros por minuto/metro cuadrado de superficie
 corporal (normal más de 2,5).
corporal (normal más de 2,5).
Figura 3
RMN cardíaca con gadolinio
Áreas “parcheadas” de realce vistas en toda las paredes ventriculares pero que son más prominentes en el septum (flecha)
El nivel elevado de BNP refleja aumento de presiones de llenado, como también lo indican las medidas hemodinámicas, que son probablemente causadas por un ventrículo enfermo o infiltrado. La apariencia no homogénea “en parches” del miocardio en la RMN sugiere un proceso infiltrativo, más que zonas necróticas. El elevado nivel de ferritina puede ser por un proceso inflamatorio o infiltrativo hepático, congestión hepática, enfermedad hepática previa (enfermedad de injerto vs huésped), y exceso de hierro debido a múltiples transfusiones durante las quimioterapias y el transplante. La función sistólica preservada y el ventrículo izquierdo hipertrófico sugieren una miocardiopatía restrictiva, como puede ocurrir en la hemocromatosis, la amiloidosis, y la sarcoidosis. La combinación de enfermedad cardíaca, hepática y niveles elevados de ferritina son muy sugestivos de hemocromatosis, pero su edad tan joven, y los hallazgos de la RMN no sostienen este diagnóstico.
Dado que una recurrencia de su cáncer todavía son una fuerte preocupación, y que el proceso parece afectar más al corazón que al pulmón, el paso siguiente sería una biopsia endomiocárdica.
RMN cardíaca con gadolinio
Áreas “parcheadas” de realce vistas en toda las paredes ventriculares pero que son más prominentes en el septum (flecha)
El nivel elevado de BNP refleja aumento de presiones de llenado, como también lo indican las medidas hemodinámicas, que son probablemente causadas por un ventrículo enfermo o infiltrado. La apariencia no homogénea “en parches” del miocardio en la RMN sugiere un proceso infiltrativo, más que zonas necróticas. El elevado nivel de ferritina puede ser por un proceso inflamatorio o infiltrativo hepático, congestión hepática, enfermedad hepática previa (enfermedad de injerto vs huésped), y exceso de hierro debido a múltiples transfusiones durante las quimioterapias y el transplante. La función sistólica preservada y el ventrículo izquierdo hipertrófico sugieren una miocardiopatía restrictiva, como puede ocurrir en la hemocromatosis, la amiloidosis, y la sarcoidosis. La combinación de enfermedad cardíaca, hepática y niveles elevados de ferritina son muy sugestivos de hemocromatosis, pero su edad tan joven, y los hallazgos de la RMN no sostienen este diagnóstico.
Dado que una recurrencia de su cáncer todavía son una fuerte preocupación, y que el proceso parece afectar más al corazón que al pulmón, el paso siguiente sería una biopsia endomiocárdica.
Se llevó a cabo una biopsia endomiocárdica del ventrículo derecho, no revelando evidencias de ninguna enfermedad infiltrativa, injuria inducida por radiación, enfermedad de injerto vs huésped, leucemia, o miocarditis en la tinción con hematoxilina-eosina, microscopía electrónica, y examen por inmunofluorescencia (Figura 4).
Figura 4: Micrografía de una muestra de biopsia de endomiocardio de  ventrículo derecho.
ventrículo derecho.
El miocardio es normal, con miocitos e intersticio normales (figura inserta). Las muestras están coloreadas con hematoxilina-eosina.
 ventrículo derecho.
ventrículo derecho.El miocardio es normal, con miocitos e intersticio normales (figura inserta). Las muestras están coloreadas con hematoxilina-eosina.
Una PCR para citomegalovirus fue negativa, así como el cultivo viral. Dado su status hemodinámico mejorado, y el resultado normal de todos los tests, los clínicos sospecharon que el evento sincopal había ocurrido como resultado de deshidratación por enfermedad viral sobreagregada, sobre una miocardiopatía restrictiva no diagnosticada previamente. Dado que repetir otra biopsia endomiocárdica fue considerada de bajo rédito diagnóstico y a la negativa por parte del paciente de someterse a nuevos tests invasivos, se le dió el alta con un plan de seguimiento ambulatorio. En dos visitas posteriores, el paciente reportó tener disnea de esfuerzo, y continuó teniendo un galope por tercer ruido. Un nuevo ecocardiograma reveló hipertrofia ventricular izquierda sin cambios, y una función sistólica igual a la determinada un mes previo. El nivel de troponina I varias semanas despés del alta permanecía elevada en niveles de 0,9 ng/ml.
La ausencia de progresión ecocardiográfica en 1 mes es una buena noticia, pero su disnea es preocupante. La elevación modesta pero persistente de la troponina ha sido descripta en pacientes con enfermdades infiltrativas, tales como la amiloidosis. Existe la posibilidad de un resultado falso negativo de la biopsia, quizá debido a error de de la toma de la muestra.
Aunque la infiltración miocárdica maligna es rara, esta posibilidad permanece siendo particularmente preocupante. Aunque una biopsia de pulmón puede ser necesaria, una nueva biopsia endomiocárdica pude ser de mayor rédito diagnóstico.
Dos meses después de la hospitalización inicial, el paciente presentó disnea aguda e hipotensión. El ecocardiograma rebeló un derrame pericárdico circunferencial complicado por taponamiento cardíaco. El paciente fue llevado a la sala de cirugía para drenaje pericárdico y biopsia miocárdica.
Cuál es el diagnóstico?
Un derrame pericárdico hemorrágico sugiere que el proceso miocárdico no es solo infiltrativo, sino también invasivo. Es probable que un cáncer altamente agresivo haya invadido el miocardio.
A pesar del drenaje del derrame pericárdico, la hipotensión refractaria y la hipoxia persistieron. Los esfuerzos para resucitarlo no fueron exitosos, y el paciente falleció rápidamente después del procedimiento. El análisis anatomopatológico reveló líquido pericárdico maligno con extensa infiltarción leucémica del miocardio. (Figura 5).
A pesar del drenaje del derrame pericárdico, la hipotensión refractaria y la hipoxia persistieron. Los esfuerzos para resucitarlo no fueron exitosos, y el paciente falleció rápidamente después del procedimiento. El análisis anatomopatológico reveló líquido pericárdico maligno con extensa infiltarción leucémica del miocardio. (Figura 5).
Figura 5
Micrografía de una biopsia incisional.
Densos infiltrados de células mononucleares están presentes en el miocardio, con blastos en el espacio intersticial (foto inserta superior), y blastos teñidos de marrón (foto inserta inferior) confirmando el fenotipo de leucemia linfoblástica aguda

Micrografía de una biopsia incisional.
Densos infiltrados de células mononucleares están presentes en el miocardio, con blastos en el espacio intersticial (foto inserta superior), y blastos teñidos de marrón (foto inserta inferior) confirmando el fenotipo de leucemia linfoblástica aguda
Comentario:
Un test falso negativo puede proyectar una larga duda diagnóstica. En este caso, una biopsia endomiocárdica negativa oscureció el diagnóstico final y dificultó el manejo.
Después de la presentación imicial con hipotensión, síncope, y evidencias electrocardiográficas de sobrecarga del corazón derecho, los médicos tratantes consideraron embolia pulmonar.
El uso de corticosteroides por períodos prolongados también hicieron que la sepsis e insuficiencia suprarrenal fueran consideradas. En el proceso de evaluación, se encontró una miocardiopatía. Comparando con un ecocardiograma previo, se observó una rápida progresión de engrosamiento de la pared ventricular; rápidamente se interpretó como un proceso infiltrativo y no como una hipertrofia.
Aunque la recurrencia del cáncer estuvo dentro de las consideraciones diagnósticas, la biopsia endomiocárdica del ventrículo derecho fue normal.
Cuando se evalúa miocardiopatías restrictivas o infiltrativas, la RMN y la biopsia endomiocárdica son los dos tests diagnósticos más importantes. Sin embargo, esos tests deben ser interpretados en el contexto del resto de la evaluación médica.
La RMN cardíaca permite evaluar las características tisulares del miocardio y del pericardio, y pueden realzar regiones de miocardio infartado (si la zona corresponde a la distribución de una rama coronaria), o pueden mostrar inflamación o infiltración si no se corresponde con una zona de distribución de una coronaria (1,2) Los tests bioquímicos (por ejemplo la investigación de cadenas livianas, electroforesis de proteínas, y ferritina plasmática) y la RMN pueden estrechar la lista de posibilidades, aunque el diagnóstico definitivo, a menudo requiere biopsia endomiocárdica. (3)
Aunque la biopsia endomiocárdica del ventrículo derecho ha sido considerado un test diagnóstico standard para los procesos restrictivos y miocardíticos, los resultados falsos negativos son comunes. (4)
Aunque la biopsia endomiocárdica del ventrículo derecho ha sido considerado un test diagnóstico standard para los procesos restrictivos y miocardíticos, los resultados falsos negativos son comunes. (4)
Aunque muy sensible para un proceso miocárdico difuso, tal como amiloidosis, la biopsia endomiocárdica es insensible para enfermedades de distribución “parcheada” o parcelar (por ej sarcoidosis). Una biopsia ventricular izquierda puede ser llevada a cabo si la RMN sugiere lesión exclusiva en ventrículo izquierdo, (5) pero este procedimiento está asociado a mayor riesgo y morbilidad. Cuando un resultado negativo es incompatible con el cuadro clínico, se debe repetir la biopsia para aumentar el rédito diagnóstico.
El linfoma, la leucemia, y sus tratamientos pueden tener profundos efectos en el miocardio y en el pericardio. (6) La radiación torácica puede inducir fibrosis del miocito, cicatrices pericárdicas, estenosis valvulares, y enfermedad aterosclerótica prematura, pero esas complicaciones no son clínicamente evidentes hasta años o décadas después del tratamiento. La quimioterapia con antraciclícos puede causar apoptosis dosis-dependiente y cardiomiopatía dilatada.
La infiltración leucémica es muy rara, pero estáperfectamente descripta en la enfermedad avanzada. (7) Aunque es improbable que un diagnóstico precoz de esta segunda recurrencia del cáncer hubiera alterado la evolución de la enfermedad, el reconocimiento del proceso antes de lo que se hizo en este caso, podría haber cambiado la evolución clínica.
Este caso subraya la importancia de la aplicación de los principios Bayesianos en todas las fases de la evaluación diagnóstica. Las consideraciones del contexto clínico son críticas cuando se interpretan los resultados de los tests diagnósticos, aún cuando esos tests se consideren los “gold standards” (patrón oro)
Traducción de :
Fool's Gold
Nicholas J. Leeper, M.D., Gurpreet Dhaliwal, M.D., Sanjay Saint, M.D., M.P.H., and Ronald M. Witteles, M.D.
Clinical Proble-Solving
Volume 359:2035-2041 November 6, 2008 Number 19