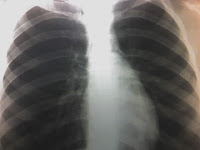
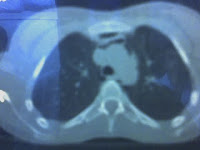
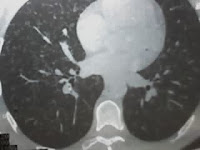
Se presenta el caso de una paciente mujer de 40 años que acude a la consulta en noviembre de 2003, para control general, refiriendo como única sintomatología
astenia.
Como antecedente presenta anemia
microcítica e hipocrómica de larga data (1994) y valores elevados de eritrosedimentación (mayores a 100).
En ese momento (1994) se realizó una
punción de médula ósea que informó: serie eritroblástica discretamente aumentada। Secuencia conservada con discretos cambios megaloblásticos. Aislados elementos con puentes intercitoplasmaticos. Serie granulocítica conservada a predominio de series maduras; algunos elementos con tendencia al gigantismo celular. Relación mieloide-eritroide 1.2/1. Megacariocitos conservados. Células reticulares conservadas de aspecto normal. Células plasmáticas discretamente elevadas de aspecto maduro. Hemosiderina en medula ósea (Reacción de Perls) negativa. No se observan células atípicas.
CONCLUSION: discreta hiperplasia de la serie eritroide, depósitos férricos ausentes y plasmocitosis de aspecto reaccional. Discretos signos de dispoyesis.
En 1995 fue internada por cuadro de pericarditis aguda. Se realizó laboratorio general, constatándose anemia, eritrosedimentación elevada, con FAN, látex y complemento normales. El ecocardiograma demostró derrame pericárdico leve. Evolucionó favorablemente y fue dada de alta en tratamiento con aspirina y sulfato ferroso.
Al momento de la consulta (2003), el examen físico revela palidez mucocutánea,signos vitales estables,índice de masa corporal normal,resto sin particularidades.
Se realiza nueva evaluación hematológica (noviembre de 2003) que demuestra
anemia,
hipergammaglobulinemia policlonaly eritosedimentación elevada (ver tabla).
Se investigan también cadenas Kappa y Lambda en orina, no detectándose cadenas livianas, con una relación Kappa/ Lambda en suero conservada.
Un nuevo ecocardiograma de control, (diciembre 2003) informa mínimo derrame pericárdico posterior.
Se realiza entonces, una nueva punción
biopsia de médula ósea (junio 2004) que informa: Tejido óseo de sostén con edema y extravasación hemática multifocal (20% vol), sinusoides dilatados. Depósitos de hemosiderina muy disminuidos. Tejido adiposo 35%. Tejido hematopoyético 45% del volumen total. Relación mieloeritroide disminuida por hiperplasia de la serie roja. Serie roja: grandes nidos con células semimaduras y maduras, cambios megaloblasticos extensos. Serie mieloide: células semimaduras, metamielocitos gigantes y predominio de polimorfonucleares. Megacariocitos escasos en numero, y se reconocen células de distinto tamaño, algunas polinucleadas y otras mononucleadas. También se observa aumento del número de plasmocitos, predominantemente perivasculares y maduros.
CONCLUSION: hiperplasia moderada de la serie eritroide, megaloblástica y discreta disminución del número de megacariocitos, con alteraciones dismórficas. Plasmocitosis reactiva (mayor a 10 % del tejido hematopoyético) acompañado de infiltrado linfohistioide intersticial.
La radiografía de cráneo (noviembre 2004) fue de características normales.
Para completar el estudio de anemia, se procede al estudio del sistema digestivo mediante una esofagogastroduodenoendoscopia (diciembre 2004), que informa: cuerpo gástrico con múltiples lesiones erosivas, algunas con evidencias de sangrado antiguo.
Antritis máculo-papulosa activa, sin lesión deprimida. Bulbo duodenal sin lesiones.
La biopsia del tracto superior diagnostica difusa antritis crónica con actividad de grado moderado, no asociado a cambio metaplásico intestinal y se reconoce la presencia de Helicobacter Pylori .
También se realiza una colonovideoendoscopía sin organicidad ni lesiones tumorales.
Cabe destacar que la paciente presenta ciclos menstruales regulares sin hipermenorrea.
Luego del tratamiento específico para erradicar H. Pylori, se realiza una segunda endoscopía y biopsia (2005) que informa: gastropatía antral reactiva (química) no asociada a H. Pylori con edema focal y congestión capilar. No se reconoce H. Pylori con la coloración realizada.
A pesar de los tratamientos con hierro, en controles posteriores persiste con astenia y los controles de laboratorio sin mejoría: la anemia, eritrosedimentación elevada e hipergammaglobulinemia eran las constantes.
Por último, se solicita ecografía abdominal (2006) que informa el hallazgo de una
formación nodular sólida de 65 mm en sentido axial por 51 mm en sentido longitudinal, ubicada por detrás del lóbulo derecho hepático, adyacente a la vesícula biliar y por delante del riñón derecho. Resto normal.
Ecografía ginecológica: Útero en AVF de tamaño normal. Endometrio de 7 mm.
TAC de abdomen y pelvis (2006): Formación expansiva sólida de 6 cm de diámetro con pequeñas calcificaciones en sus paredes y que refuerza con contraste, ubicada por debajo del lóbulo hepático derecho y la vesícula biliar. Tiene contacto con la fascia de Gerota y la cara anterior del riñon derecho por su parte posterior y con la fascia transversalis en su parte anterior. La lesión aparenta ser independiente. Se observa pequeña cantidad de líquido libre en fondo de saco de Douglas. Imagen quística en anexo derecho. Resto sin alteraciones.
RMN de abdomen (2006): Sobre la zona del flanco derecho, en la región subhepática entre el lóbulo derecho del hígado y el riñon derecho se observa una MOE de contornos netos, perfectamente definidos que mide aproximadamente 64 mm de diámetro anteroposterior y 52 mm de diámetro vertical. Isointenso a la masa muscular en T1. Tenuemente hiperintenso y heterogéneo en T2. Presenta un intenso realce post-inyección de gadolinio endovenoso. Provoca compresión extrínseco de las estructuras vecinas sin invadirlas. No se observan adenomegalias retroperitoneales ni ascitis.
Se realiza procedimiento diagnóstico.
Tabla: Laboratorio (2003) Glóbulos rojos 3।700.000 x mm3 Hemoglobina 8.20 grs. % Hematocrito 29%
Valor globular 0।74 V।C.M 78.37 fl Leucocitos 4।200 x mm 3 . Neutrófilos en cayado 0 %। Neutrófilos seg 78 %
Eosinófilos 0 % Basófilos 2 Linfocitos 17 % Monocitos 3 % Plaquetas 220।000
Bilirrubina T 4.20mg/l (D 1.10mg/l - Ind 3.10mg/l) Enzimas hepáticas normales. Función renal: normal.
Orina completa: normal। Reticulocitos 2 % Sideremia 64 ug/ dl TIBC 234 ug % । Porcentaje de saturación 27.30 %
Ferritina 67।5 ng/ml (VN: 9-120 ng/ml) VES: 140 mm /h। PCR 12 mg/l Dosaje de Ig A 418 mg/ dl ( 110- 195) Ig G 2859 mg/dl (850- 1450) Ig M 323 mg/dl (100-200) Complemento C3: 175 mg/d Complemento C4: 26 mg/dl CH 50: 30 u.h. 50% FAN: negativo AntiADN: negativo Latex: 10 UI/ml. HIV negativo
Año 2006 CA 125 4।78 U/ml (VN menor de 35U/ml) CEA 0।98 U/ml (VN hasta 4.6 U/ml)
El procedimiento diagnóstico fue una biopsia incisional por punción y el diagnóstico definitivo de la misma fue :
Enfermedad de Castleman (no consta la variedad histológica)
Después de obtener el resultado , se completó la estadificación del cuadro y se procedió a la escisión quirúrgica completa de la masa tumoral la cual pudo realizarse técnicamente sin inconvenientes.
La evolución de la paciente fue excelente con mejoría de su cuadro de astenia, la desaparición de la anemia, la hipergamaglobulinemia y la eritrosedimentación acelerada.
La remisión clínico humoral se mantiene varios años después del tratamiento
Enfermedad de CastlemanEs una enfermedad de los ganglios linfáticos y tejidos relacionados, descripta primeramente por Benjamín Castleman en Boston en 1956.
Aunque no se la considera una enfermedad cancerosa , la forma multicéntrica de la enfermedad se parece mucho a un linfoma. Además muchos pacientes evolucionan a linfomas. Se caracteriza por crecimiento de células no cancerosas que desarrollan en los ganglios linfáticos en un sitio único o en forma diseminada. Las células comprometidas pertenecen al linaje B y a menudo producen secreción de citoquinas sobre todo IL6 que es la responsable de muchos, o de casi todos los síntomas cuando los hay ( fiebre, sudoración, pérdida de peso), así como las manifestaciones de laboratorio (anemia, VSG acelerada etc). Hay varias formas clínicas e histopatológicas de Enfermedad de Castleman (EC). Desde el punto de vista clínico hay dos formas : la
forma localizada y la
forma multicéntrica , y desde el punto de vista histológico también hay dos formas: la
Hialino vascular y la
Plasmocitaria.
En su patogenia se ha implicado en forma relativamente reciente al Herpes virus Humano tipo 8 (HHV8) (sobre todo en la forma multicéntrica de la enfermedad) que es a su vez causante de Sarcoma de Kaposi. En este caso, de que la enfemedad sea multicéntrica y esté asociada a la infección del HHV8, la IL6 sería codificada por un gen viral ( v IL6)
Usualmente, el paciente con tipo vascular hialino es asintomático y tiene una evolución en general benigna, pero el de tipo plasmocelular frecuentemente se asocia con síntomas sistémicos que ameritan resección quirúrgica, seguimiento estrecho e incluso hasta quimioterapia.En una serie importante de casos la mayoría de los pacientes eran niños o adultos jóvenes cuya manifestación clínica principal era la presencia de una masa abdominal o mediastínica con algunas anormalidades de laboratorio, tales como anemia, hipoalbuminemia, eritrosedimentación elevada e hiperglobulinemia policlonal. Sin embargo, se han dado reportes que manifiestan características clínicas poco usuales, como por ejemplo, una variante mixta o transicional de la enfermedad de Castleman asociada con derrames pleurales quilosos bilaterales. En otra serie se reporta que las adenopatías generalmente se encuentran localizadas en el tórax (60%), cuello (14%), abdomen (11%) y axilas (4%). Sin embargo ocasionalmente se han reportado localizaciones atípicas, tales como una lesión única intracraneal descrita por Hashimoto. En algunas oportunidades la EC ha sido reportada en asociación con otras patologías, entre ellas sarcoma de Kaposi , glomerulonefritis y lupus eritematoso sistémico. También se ha asociado con condiciones más atípicas tales como fenómenos trombóticos asociaciado con una trombosis de la vena cava superior, y las asociaciones con síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, proteinemia monoclonal y cambios cutáneos). Lo anterior demuestra que la EC es una condición clínica que representa un reto para el diagnóstico clínico, ya que además de la presentación de las adenopatías, puede tener asociaciones con múltiples condiciones que pueden hacer difícil establecer el diagnóstico.
Etiología y etiopatogeniaLa causa real de la EC es desconocida hasta la fecha y la evidencia actual es escasa y especulativa, pero se han demostrado que pudiera existir alguna relación entre el virus humano herpes 8 (HHV8) al documentar que 3 pacientes con EC tipo multicéntrica mostraron anticuerpos séricos elevados para HHV8. Recientemente se ha encontrado secuencias de DNA del HHV8 en los ganglios linfáticos de pacientes con EC multicéntrica y los datos actuales sugieren que la sobreproducción de IL-6 por lo nódulos linfáticos hiperplásicos juegan un papel determinante en el desarrollo de las formas clínicas de la EC. En el caso de EC asociada a infección por HHV8 y SK el genoma viral codificaría la IL6 en cuyo caso esta se llama (vIL6). Este virus es llamado también herpes virus asociado a sarcoma de Kaposi (KSHV) debido a que ha sido encontrado en muestras de tejido de sarcoma de Kaposi de pacientes con sida. La IL-6 es una proteína multifuncional que está involucrada en procesos de proliferación, diferenciación y maduración. Su principal papel es estimular a los hepatocitos para producir proteínas de fase aguda, pero además es un factor de crecimiento y diferenciación de los linfocitos B para que se transformen en células plasmáticas. El estado de proliferación persistente de linfocitos y/o de células plasmáticas resultante propiciaría el desarrollo de linfomas malignos. Otro efecto de la IL-6 resulta en la continua estimulación de las células endoteliales, por la liberación de factores de crecimiento angiogénicos o vasculares, que podría llevar a la formación de neoplasias de origen vascular, además, la IL-6 tiene efectos moduladores sobre la función inmune y la hematopoyesis, y muchas de las manifestaciones sistémicas observadas en la EC como debilidad, fiebre, presencia de reactantes de fase aguda e hipergammaglobulinemia, podrían explicarse por la elevación de los niveles séricos de IL-6. Asismismo, los niveles elevados de IL-6 parecieran ser los responsables de la patogénesis de las manifestaciones renales que han sido descritas, así como de producir un efecto inhibitorio en la diferenciación eritroide reflejado por una eritropoyesis hipoproliferativa y anemia microcítica. Además de la EC, la IL-6 ha sido implicada en la patología del mieloma múltiple, la artritis reumatoide y la osteoporosis post-menopáusica y la psoriasis.
Otras de las causas patogénicas implicadas incluyen inflamación crónica de baja intensidad, procesos hamartomatosos, estados de inmunodeficiencia y autoinmunidad, además de infecciones con virus de Ebstein-Barr, toxoplasmosis y Mycobacterium tuberculosis.
Manifestaciones clínicasLas manifestaciones clínicas de la Enfermedad de Castleman (EC)dependen fundamentalmente de la variedad histológica. Usualmente la variedad vascular hialina se presentó como una adenopatía única sin manifestaciones sistémicas y la variante plasmocelular se asocia con múltiples manifestaciones clínicas y de laboratorio. Muchas manifestaciones clínicas se han asociado con la EC.
Variedad vascular hialinaLa gran mayoría de las veces la variedad vascular hialina (VVH) es la de un tumor asintomático y localizado que se descubre en forma accidental. Afecta principalmente a adultos jóvenes del sexo femenino. La localización tumoral más frecuente es mediastinal, seguida del cuello y abdominal; aunque ha sido descrita en muchos sitios, como en la pared torácico, mediastino, retroperitoneo, músculo-esquelético, axilas, parénquima pulmonar, pelvis, región inguinal y supraclavicular, mesenterio y hasta en el cerebro con tamaños tan diversos que oscilan entre 2.5 hasta 12cm. Esta variante casi nunca recurre después de la resección quirúrgica. Ocasionalmente presenta sintomatología asociada. En una serie importante, la VVH de asoció a síntomas tan diversos como lumbalgia, ardor axilar, dolor torácico artralgias, mialgias, parestesias de las manos y pies, tos productiva, disnea, dedos hipocráticos, elevación de las pruebas de función hepática y eritrosedimentación aumentada, trombocitopenia, anemia, leucopenia, hipoalbuminemia y elevación de los niveles séricos de IL-6.
Variedad plasmocelularOcurre principalmente en 2 formas: localizada y multicéntrica. La primera afecta un solo sitio anatómico. Puede afectar a sujetos de cualquier edad, pero más frecuentemente a los adultos jóvenes. Los síntomas sistémicos son frecuentes e incluyen pérdida de peso y fatiga, alteraciones de laboratorio tales como anemia, eritrosedimentación elevada e hipergamaglobulinemia. Después de la escisión quirúrgica los síntomas usualmente desaparecen.
La forma multicéntrica es histológicamente similar a la forma localizada, es una enfermedad sistémica con linfadenopatías generalizadas. Tiene un curso clínico agresivo y fatal asociado con complicaciones infecciosas y con riesgo de desarrollar tumores malignos, tales como linfoma o sarcoma de Kaposi. Usualmente evoluciona en uno de 4 cursos: recaídas y remisiones, estable y persistente, rápidamente fatal y/o transformación a linfoma maligno. Muchos enfermos asocian hepatoesplenomegalia, síntomas neurológicos y enfermedad renal. La mayoría de los pacientes con enfermedad del tipo plasmocelular son adultos jóvenes.
En una serie, la edad promedio fue de 35 años (rango de 26-72), con mayor frecuencia en el sexo femenino. Los pacientes presentaron; fatiga (100%), fiebre (31%), pérdida de peso (62%) y sudoración nocturna (62%). Las adenopatías fueron periféricas (100%), abdominales (62%) y mediastínicas (25%). También presentaban esplenomegalia (50%), hepatomegalia (25%) y se asociaron en un 12% a linfoma no Hodgkin .
La enfermedad multicéntrica puede ameritar quimioterapia o radioterapia para los casos en los que no se puede resecar la lesión. A pesar de tratamientos agresivos, la sobrevida media para la enfermedad multicéntrica es de aproximadamente 26 meses, comparado con casi un 100% de sobrevida a los 5 años para la forma localizada vascular hialina de la enfermedad de Castleman. La variante multicéntrica plasmocelular se asocia más tipicamente con sarcoma de Kaposi y se ha descrito en pacientes con HIV puede asociarse tardíamente con neoplasias vasculares, las que pueden desarrollarse incluso hasta 8 años después del diagnóstico inicial de la enfermedad, por lo que es necesario un seguimiento de los pacientes a largo plazo.
Tratamiento:
En la forma localizada la resección quirúrgica es generalmente curativa y el pronóstico es excelente. La forma multicéntrica tiene peor pronóstico con una expectativa de vida de 2 años, pudiendo evolucionar a Anemia Hemolítica Autoinmune o Linfoma no Hodgkin. En los pacientes HIV positivos y evidencias de infección por Herpes Virus Humano Tipo 8 y Sarcoma de Kaposi el tratamiento con Aciclovir y Rituximab (anti CD 20) puede mejorar el pronóstico. Se han hecho ensayos con Tocilizumab, un anticuerpo monoclonal humanizado anti IL6 que mostró revertir las manifestaciones clínicas y de laboratorio de la Enfermedad de Castleman
Conclusiones: se presentó una paciente con antecedentes de Anemia microcítica hipocrómica y VSG acelerada de varios años de evolución con relativo buen estado general y con la única sintomatología de astenia. La anemia y VSG de > 100 mm acelerada se remontaban a nueve años atrás.
El síndrome anémico fue caracterizado como anemia por déficit de hierro debido a que la paciente presentaba en la coloración de Perls con ferrocianuro de potasio en MO la ausencia de hierro en forma de Hemosiderina, lo cual es un dato que confirma la ferropenia, mas allá de que el frotis de sangre periférica eran muy sugestivas de esa condición, así como los índices hematimétricos(VCM 78,37 fl ). La presencia de una ferremia normal, saturación de Transferrina de 27% y una Ferritina de 67,5 ng/ml, esta última probablemente como reactante de fase aguda, no descartan la ausencia de hierro.
El porcentaje de reticulocitos de 2% para su grado de anemia de 3.700.000 GR/mm3 da un valor absoluto de 74.000 reticulocitos /mm3, lo que la clasifica como anemia hiporegenerativa
Es interesante la presencia de Bilirrubina alta a expensas de la B Indirecta, ya que la misma puede darse en una situación de hemólisis o en un Síndrome de Gilbert. Lamentablemente no constan en la historia clínica otros elementos indicativos de hemólisis como LDH y Haptoglobina sérica. La ausencia de reticulocitosis aboga contra un fenómeno hemolítico aunque si este está asociado a déficit severo de hierro podría darse hipotéticamente la asociación de hemólisis con reticulocitopenia.
En el laboratorio llamó la atención la presencia de una hipergamaglobulinemia policlonal muy significativa de 3,6 grs de gammaglobulina/100 ml a expensas de IgG, IgM, e IgA. Las hipergamaglobulinemias pueden ser a expensas de un tipo de inmunoglobulina (monoclonal) o de varias de ellas (policlonal). Cuando son monoclonales, además de verse un aumento “angosto” en la corrida electroforetica, hay generalmente una disminución del resto de las inmunoglobulinas, motivo por el cual el Mieloma Múltiple o la Macroglobulinemia de Waldenstrom por ejemplo, cursan con inmunodepresión.
En el caso de nuestra paciente, presentaba una hipergamaglobulinemia a expensas de todas las inmunoglobulinas, porque aunque no consta en la historia clínica la imagen del proteinograma electroforético, se puede observar la cuantificación de por lo menos 3 de ellas (IgG, IgA, e IgM), por inmunodifusión radial cuantitativa. El significado de esta hipergamaglobulinemia en nuestra paciente es de carácter inespecífico, y en la Enfermedad de Castleman se debe a la Hipersecreción de IL6, y tiene como sustrato el aumento del porcentaje de células plasmáticas observado en la PAMO (>10%).
La Interleukina 6 es una glucoproteína segregada por los macrófagos , las células T, las células endoteliales y los fibroblastos. Su liberación es inducida por IL1 y se incrementa en respuesta a TNF alfa. La IL6 es una citoquina tanto proinflamatoria como antiinflamatoria, y se segrega en respuesta al trauma, quemaduras, y cualquier tipo de inflamación. También es una miokima, o sea una citoquina secretada por el músculo, y se eleva en la contracción muscular. Está aumentada en respuesta al ejercicio muscular movilizando sustratos extracelulares. Adicionalmente los Osteoblastos secretan IL6 para estimular la formación de Osteoclastos. Las células musculares lisas en la túnica media de muchos vasos sanguíneos también producen IL6 como citoquina proinflamatoria.
La IL6 es uno de los mas importantes mediadores de la fiebre y de la respuesta de fase aguda. En el músculo y el tejido graso la IL6 estimula la movilización de energía. La IL-6 es una proteína multifuncional que está involucrada en procesos de proliferación, diferenciación y maduración. Su principal papel es estimular a los hepatocitos para producir proteínas de fase aguda, pero además es un factor de crecimiento y diferenciación de los linfocitos B para que se transformen en células plasmáticas. El estado de proliferación persistente de linfocitos y/o de células plasmáticas resultante propiciaría el desarrollo de linfomas malignos. Otro efecto de la IL-6 resulta en la continua estimulación de las células endoteliales, por la liberación de factores de crecimiento angiogénicos o vasculares, que podría llevar a la formación de neoplasias de origen vascular, además, la IL-6 tiene efectos moduladores sobre la función inmune y la hematopoyesis, y muchas de las manifestaciones sistémicas observadas en la EC como debilidad, fiebre, presencia de reactantes de fase aguda e hipergammaglobulinemia, podrían explicarse por la elevación de los niveles séricos de IL-6. Asismismo, los niveles elevados de IL-6 parecieran ser los responsables de la patogénesis de las manifestaciones renales que han sido descritas, así como de producir un efecto inhibitorio en la diferenciación eritroide reflejado por una eritropoyesis hipoproliferativa y anemia microcítica
Se podría decir para concluir, que la Enfermedad de Castleman es un modelo de enfermedad producida por una citoquina, ya que ésta, la IL6 está implicada en la patogénesis de la enfermedad desde sus estadios mas tempranos produciendo señales de proliferación, síntesis, maduración y diferenciación que a veces culminan con la transformación neoplásica. Quizá sea un modelo simple para comprender la patogenia de casi todas las enfermedades, simple en el sentido de la presencia de una sola citoquina, a diferencia de la mayoría de otras entidades donde la combinación de varias de ellas en forma sucesiva , secuencial o simultánea le van dando el perfil específico
En el caso de nuestra paciente, lamentablemente no consta en la historia clínica la variedad histológica, aunque si sabemos que era una forma localizada de la enfermedad y que se comportó como tal después del tratamiento quirúrgico con remisión de todos sus síntomas, signos y manifestaciones de laboratorio
BibliografíaAnti-interleukin-6 receptor antibody treatment in inflammatory autoimmune diseases.
Rev Recent Clin Trials. 2006 Sep;1(3):193-200. Review.
PMID: 18473972 [PubMed - indexed for MEDLINE]
Ding C, Jones G.Multicentric Castleman's disease in two cases.
Indian J Pediatr. 2007 Dec;74(12):1116-20. Review.
PMID: 18174650 [PubMed - indexed for MEDLINE
Sharma R, Seth R, Thavaraj V, Bagga A, Kabra SK, Karak AK, Atri S
Kaposi sarcoma-associated herpesvirus/human herpesvirus 8 and lymphoproliferative disorders.
J Clin Pathol. 2007 Dec;60(12):1350-7. Review.
PMID: 18042691 [PubMed - indexed for MEDLINE]
Du MQ, Bacon CM, Isaacson PG.
[Two HHV8-related illnesses in a HIV-negative patient: Kaposi's sarcoma and multicentric Castleman's disease. Response to treatment with Rituximab and CHOP]
Actas Dermosifiliogr. 2006 Jul-Aug;97(6):385-90. Review. Spanish.
PMID: 16956518 [PubMed
Pastor MA, Vasco B, Mosquera JM, Debén G, Bautista P, Requena L.
Fifty years of multicentric Castleman's disease.
Acta Oncol. 2004;43(8):698-704. Review.
PMID: 15764213 [PubMed - indexed for MEDLINE]
Waterston A, Bower M.
Update on Kaposi's sarcoma and other HHV8 associated diseases. Part 2: pathogenesis, Castleman's disease, and pleural effusion lymphoma.
Lancet Infect Dis. 2002 Jun;2(6):344-52. Review.
PMID: 12144897 [PubMed - indexed for MEDLINE]
Hengge UR, Ruzicka T, Tyring SK, Stuschke M, Roggendorf M, Schwartz RA, Seeber S.
[Castleman's disease in patients infected with HIV]
Rev Med Interne. 2002 Feb;23(2):155-63. Review. French.
PMID: 11876059 [PubMed - indexed for
Aaron L, Lidove O, Viard JP, Troisvallet D, Piketty C, Vittecoq D, Zucman D, Blétry O, Dupont B.
KSHV/HHV8-associated lymphoproliferations in the AIDS setting.
Eur J Cancer. 2001 Jul;37(10):1217-26. Review.
PMID: 11423254 [PubMed - indexed for MEDLINE]
Schulz TF.Castleman's disease and related disorders.
Semin Diagn Pathol. 1988 Nov;5(4):346-64. Review.
PMID: 2464187 [PubMed - indexed for MEDLINE
Frizzera G.
Castleman disease.
Curr Opin Hematol. 2007 Jul;14(4):354-9. Review.
PMID: 17534161 [PubMed - indexed
Dham A, Peterson BA
Interleukin 6: from bench to bedside.
Nat Clin Pract Rheumatol. 2006 Nov;2(11):619-26. Review. Erratum in: Nat Clin Pract Rheumatol. 2006 Dec;2(12):691.
PMID: 17075601 [PubMed - indexed for MEDLINE
Nishimoto N, Kishimoto T.
[Anti-interleukin-6 receptor antibody therapy--from bedside to bench]
Nihon Rinsho Meneki Gakkai Kaishi. 2006 Oct;29(5):289-94. Review. Japanese.
PMID: 17075187 [PubMed - indexed for
Nishimoto N.
Human herpesvirus-8: beyond Kaposi's .
Isr Med Assoc J. 2006 Jul;8(7):489-93. Review.
PMID: 16889165 [PubMed - indexed for MEDLINE
Rimar D, Rimar Y, Keynan Y.
."Cytokines and the brain corticosteroid receptor balance: relevance to pathophysiology of neuroendocrine-immune communication.". Psychoneuroendocrinology 19 (2): 121-34.
De Kloet ER, Oitzl MS, Schöbitz B (1994).
FIEDLER-VELASQUEZ, Eduardo, GOURZONG- TAYLOR, Charles, GOYENAGA-HERNANDEZ, Pedro et al. Enfermedad de Castleman. Reporte de 14 casos de 1990-2002 en el "Hospital Dr. Rafael Angel Calderón Guardia", dos con presentación inusual y revisión de literatura. Acta méd. costarric. [online]. jul. 2005, vol.47, no.3
 Paciente de sexo masculino, 59 años de edad, que consulta hace cuatro meses atrás a su medico de cabecera, por presentar un cuadro de:
Paciente de sexo masculino, 59 años de edad, que consulta hace cuatro meses atrás a su medico de cabecera, por presentar un cuadro de:
 enzado el cuadro y ante la progresión de la sintomatología, el paciente decide realizar una consulta con gastroenterología. Se interpreta el cuadro como Síndrome pilórico
enzado el cuadro y ante la progresión de la sintomatología, el paciente decide realizar una consulta con gastroenterología. Se interpreta el cuadro como Síndrome pilórico



 tias, afecciones ginecológicas), o a intoxicaciones en particular el tabaquismo
tias, afecciones ginecológicas), o a intoxicaciones en particular el tabaquismo ubo digestivo alto, con secuestro de líquido del intravascular, con el cuadro hemodinámico consiguiente.
ubo digestivo alto, con secuestro de líquido del intravascular, con el cuadro hemodinámico consiguiente.



 rica descripta en las imágenes. Ésta puede o no , tener que ver con el DIU supuestamente extrauterino. De ser así habría que preguntarse porqué después de cuatro años comienza con un cuadro de dolor agudo. Una explicación sería que esta masa está comprometiendo algún asa de ileon terminal y produciendoun cuadro subobstructivo. Eso explica el carácter cólico del dolor, algunas asas distendidas en la Rx de abdomen y las deposiciones blandas que refiere la paciente siguiendo al dolor cólico.
rica descripta en las imágenes. Ésta puede o no , tener que ver con el DIU supuestamente extrauterino. De ser así habría que preguntarse porqué después de cuatro años comienza con un cuadro de dolor agudo. Una explicación sería que esta masa está comprometiendo algún asa de ileon terminal y produciendoun cuadro subobstructivo. Eso explica el carácter cólico del dolor, algunas asas distendidas en la Rx de abdomen y las deposiciones blandas que refiere la paciente siguiendo al dolor cólico.










 Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.
Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.